馬上就要高考了,同學們要在這最后關頭抓緊時間復習備考,考上自己最理想的大學。下面是小編為大家帶來的一份海南2017屆高三4月調研測試化學試題及答案,答案都講解得非常仔細,需要的快來下載看看吧!
海南2017屆高三4月調研測試化學答案預覽
一起來看看吧!
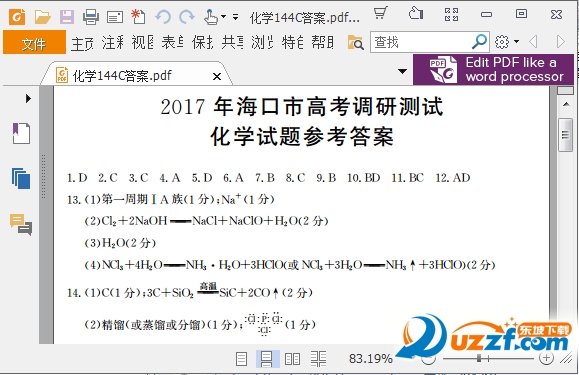
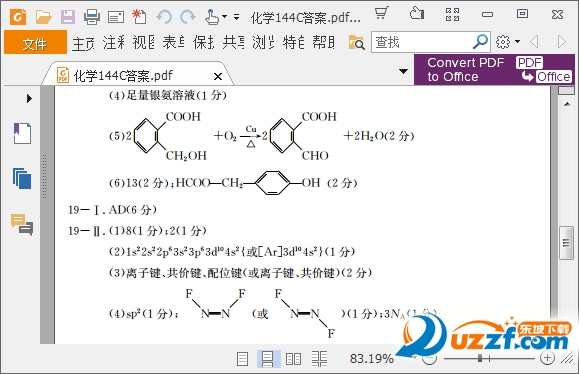
氧化性和還原性強弱的判斷方法
1、根據化合價判斷
對同一元素而言,價態越高,氧化性越強,如Fe< Fe2+ <Fe3+ 。價態越低,氧化性越弱,S2? <S< SO32? 。
特例:氧化性HClO> HClO2>HClO3> HClO4
2、根據金屬活潑性判斷
金屬的金屬性越強,單質的還原性越強,其對應離子為氧化性越弱。
單質還原性:按金屬活動性表的順序依次減弱。
離子氧化性:按金屬活動性表的順序依次增強(鐵指Fe2+)。如氧化性:Ag+> Hg2+> Fe3+> Cu2+> H+> Fe2+
3、根據非金屬的活潑性判斷
非金屬性越強,單質的氧化性越強,其對應離子的還原性越弱。
單質氧化性:F2>Cl2>Br2 >I2>S
離子還原性:S2?>I?>Br?>Cl?>F?
4、通過化學反應比較
對于自發的氧化還原反應氧化劑+還原劑→氧化產物+還原產物來說,氧化劑的氧化性大于氧化產物,還原劑的還原性大于還原產物;
如Cu+2FeCl3=2FeCl2+CuCl2說明銅的還原性大于亞鐵離子,同時鐵離子的氧化性大于銅離子。
5、通過相近的反應比較
變價金屬與氧化劑反應,被氧化的價態越高,其氧化劑的氧化性越強
如:Fe+ Cl2→FeCl3; Fe+S→FeS可得出氧化性:Cl2>S
6、由反應條件的難易比較
不同氧化劑與同一還原劑反應時,反應條件越易,氧化性越強;不同還原劑與同一氧化劑反應時,反應條件越易,還原性越強:
如:鹵素單質與H2的反應,按F2、Cl2、Br2、I2的順序反應越來越難,反應條件要求越來越高.則可得出氧化性:F2>Cl2> Br2>I2
7、影響氧化劑的氧化性和還原劑的還原性的其它因素
①溫度:如濃硫酸具有強氧化性,熱的濃硫酸比冷的濃硫酸氧化性要強:
②濃度:如硝酸具有強氧化性,硝酸越濃其氧化性越強。
③酸堿性:如KMnO2的氧化性隨溶液酸性的增強而增強(一般地,在酸性環境中,KMnO4的還原產物Mn2+,在中性環境中,KMnO4的還原產物為MnO2,在堿性環境中,KMnO4的還原產物為K2MnO4)。
- PC官方版
- 安卓官方手機版
- IOS官方手機版

















 七彩課堂教科版科學1-6年級上冊教學資源包電子版
七彩課堂教科版科學1-6年級上冊教學資源包電子版
 23秋七彩課堂英語人教版九年級上冊教學資源包【課件+教案】
23秋七彩課堂英語人教版九年級上冊教學資源包【課件+教案】
 七彩課堂人教版英語八年級上冊課件PPT【教案】
七彩課堂人教版英語八年級上冊課件PPT【教案】
 23秋初中英語人教版七年級上冊教學資源包【課件+教案】
23秋初中英語人教版七年級上冊教學資源包【課件+教案】
 23秋七彩課堂人教PEP版英語四年級上冊教學資源包最新版
23秋七彩課堂人教PEP版英語四年級上冊教學資源包最新版
 23秋初中數學人教版九年級上冊教學資源包[課件+教案]
23秋初中數學人教版九年級上冊教學資源包[課件+教案]
 23秋七彩課堂人教版數學八年級上冊教學資源包最新版
23秋七彩課堂人教版數學八年級上冊教學資源包最新版
 23秋七彩課堂人教版數學七年級上冊課件PPT電子版
23秋七彩課堂人教版數學七年級上冊課件PPT電子版
 23秋七彩課堂統編版語文九年級上冊課件PPT最新版
23秋七彩課堂統編版語文九年級上冊課件PPT最新版
 23秋七彩課堂統編版語文八年級上冊教學資源包【課件+教案】
23秋七彩課堂統編版語文八年級上冊教學資源包【課件+教案】
 2023年秋七彩課堂語文課件1-6年級上冊合集【課件+教案】
2023年秋七彩課堂語文課件1-6年級上冊合集【課件+教案】
 2023嘉善空中課堂客戶端1.7.73 官方版
2023嘉善空中課堂客戶端1.7.73 官方版
 智慧中小學電腦版1.10 官方版
智慧中小學電腦版1.10 官方版
 優巡監考系統電腦客戶端v1.1.1_t 官方版
優巡監考系統電腦客戶端v1.1.1_t 官方版
 日照教育云電腦版1.0.7 安卓版
日照教育云電腦版1.0.7 安卓版
 天一閱卷系統客戶端v3.5 官方PC版
天一閱卷系統客戶端v3.5 官方PC版
 人教教學易電腦客戶端1.5.0.13 官方版
人教教學易電腦客戶端1.5.0.13 官方版
 學思教師用書專用平臺電子試卷【支持打印】免費版
學思教師用書專用平臺電子試卷【支持打印】免費版
 國家中小學智慧教育平臺電子教材(中小學電子教材)可打印版
國家中小學智慧教育平臺電子教材(中小學電子教材)可打印版
 新教科版六年級科學下冊課件【課件+教學設計】
新教科版六年級科學下冊課件【課件+教學設計】
 七彩課堂人教版pep六年級下冊英語課件最新版
七彩課堂人教版pep六年級下冊英語課件最新版
 高途課堂pc客戶端下載8.9.1 簡體中文官方版
高途課堂pc客戶端下載8.9.1 簡體中文官方版
 豌豆思維PC客戶端2.17.0 電腦版
豌豆思維PC客戶端2.17.0 電腦版
 學而思網校電腦客戶端v9.71.2 官方免費版
學而思網校電腦客戶端v9.71.2 官方免費版
 掌門優課學生客戶端1.1.12 學生版
掌門優課學生客戶端1.1.12 學生版
 拓課云課堂客戶端4.1.9 官方最新版
拓課云課堂客戶端4.1.9 官方最新版
 鯨魚外教培優客戶端(鯨魚學堂)2.2.5pc版
鯨魚外教培優客戶端(鯨魚學堂)2.2.5pc版
 有道云教室教師端2.1.1 電腦版
有道云教室教師端2.1.1 電腦版
 好分數輔導電腦版2.1.79.3 官方最新版
好分數輔導電腦版2.1.79.3 官方最新版
 學霸君有課客戶端1.0.10.0 pc版
學霸君有課客戶端1.0.10.0 pc版
 猿輔導老師版客戶端5.60.0官方免費版
猿輔導老師版客戶端5.60.0官方免費版


 eztest考試系統1.2.11 官方版
eztest考試系統1.2.11 官方版 七彩課堂二年級上冊語文課件2023秋季更新部
七彩課堂二年級上冊語文課件2023秋季更新部 七彩課堂部編版一年級上冊語文課件+教案202
七彩課堂部編版一年級上冊語文課件+教案202 七彩課堂統編版四年級上冊語文ppt課件電子版
七彩課堂統編版四年級上冊語文ppt課件電子版 七彩課堂統編版六年級上冊語文ppt課件【課件
七彩課堂統編版六年級上冊語文ppt課件【課件 七彩課堂部編版五年級上冊語文教學課件PPT2
七彩課堂部編版五年級上冊語文教學課件PPT2 青島市促進中小學生全面發展十個一項目管理
青島市促進中小學生全面發展十個一項目管理 2023春七彩課堂四年級下冊語文課件PPT【課件
2023春七彩課堂四年級下冊語文課件PPT【課件 七彩課堂人教版一年級上數學課件+課練電子版
七彩課堂人教版一年級上數學課件+課練電子版 唐詩三百首全集mp3格式免費版
唐詩三百首全集mp3格式免費版